Abstract:
Background: Antibiotic-associated diarrhoea (AAD) is the most common intestinal side effect of an antibiotic therapy. Various probiotics or probiotic combinations are often used preventively while taking antibiotics for the prevention of AAD.
Method: This review is based on a systematic literature research in MEDLINE and EMBASE. 7 probiotics are presented with regard to their effectiveness and evidence in the prevention of AAD. Only preparations classified by the World Gastroenerology Organization (WGO) with evidence levels 1-3 for the prevention of AAD were taken into account. 37 clinical studies, including 33 RCTs, were evaluated.
Results: Saccharomyces (S.) boulardii CNCM I-745 is the most extensively studied probiotic regarding the prevention of AAD. It has shown evidence-based efficacy in all patient groups (outpatients and hospitalized children and adults). Lactobacillus rhamnosus GG also has a good evidence regarding the prevention of AAD in children and outpatient adults. The other probiotics and probiotic combinations evaluated in the present study only show efficacy in hospitalized patients or only show very limited evidence regarding their efficacy in the prevention of AAD due to the underlying study design or the small number of patients.
Conclusion: The effect of probiotics is strain-specific, no general statement can be made about the efficacy of probiotics in the prevention of AAD. In principle, it is advisable to select a probiotic with an evidence-based effect such as S. boulardii CNCM I-745 or Lactobacillus rhamnosus GG to prevent AAD.
Zusammenfassung
Hintergrund: Die Antibiotika-assoziierte Diarrhö (AAD) stellt die häufigste intestinale Nebenwirkung einer Antibiotikatherapie dar. Verschiedene Probiotika oder Probiotikakombinationen werden oft während der Antibiotikaeinnahme präventiv angewendet, um der Entstehung einer AAD vorzubeugen.
Methode: Die Übersichtsarbeit basiert auf einer systematischen Literaturrecherche in MEDLINE und EMBASE. Es werden 7 Probiotika hinsichtlich ihrer Wirksamkeit und Evidenz bei der Prävention der AAD dargestellt. Nur Präparate, die von der World Gastroenerology Organisation (WGO) mit Evidenzlevel 1-3 zur Prävention der AAD eingestuft waren, wurden berücksichtigt. 37 klinische Studien, davon 33 RCTs wurden ausgewertet.
Ergebnisse: Saccharomyces boulardii CNCM I-745 ist das am umfangreichsten untersuchte Probiotikum hinsichtlich der Prävention der AAD. Es zeigte in allen Patientengruppen (ambulant und stationär behandelte Kinder und Erwachsene) eine evidenzbasierte Wirksamkeit auf. Auch Lactobacillus rhamnosus GG besitzt eine gute Studienlage bei Kindern und ambulant behandelten Erwachsenen. Die weiteren Probiotika und Probiotikakombinationen, welche in der vorliegenden Arbeit bewertet wurden, zeigen lediglich eine Wirksamkeit bei hospitalisierten Patienten auf oder es liegt nur eine sehr eingeschränkte Evidenz für die Wirksamkeit hinsichtlich der Prävention einer AAD vor, beispielsweise aufgrund des zugrundeliegenden Studiendesigns bzw. der geringen Anzahl an Patienten.
Schlussfolgerung: Probiotika wirken stammspezifisch, über ihre Wirksamkeit bei der Prävention einer AAD kann keine allgemeine Aussage getroffen werden. Grundsätzlich empfiehlt es sich, zur Prävention der AAD ein Probiotikum mit evidenzbasierter Wirkung auszuwählen wie beispielsweise Saccharomyces boulardii CNCM I-745 oder Lactobacillus rhamnosus GG.
Schlüsselwörter: Antibiotika-assoziierte Diarrhö, Darm-Hirn-Achse, Prävention, Saccharomyces boulardii CNCM I-745, Lactobacillus rhamnosus GG, Probiotika
Eingereicht am 12.2.2021 - Revision akzeptiert am 11.3.2021
Similar content being viewed by others
Avoid common mistakes on your manuscript.
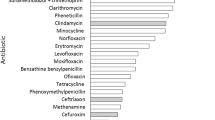
Bei einer Antibiotikatherapie ist die Antibiotika-assoziierte Diarrhö (AAD) die am häufigsten auftretende Nebenwirkung mit einer Inzidenz von 5-35% [1]. Neben dem Alter und dem allgemeinen Gesundheitszustand des Patienten, ist die Häufigkeit der AAD auch von dem verwendeten Antibiotikum sowie der Anwendungsdauer abhängig. Insbesondere die Einnahme von Antibiotika wie Clindamycin, Breitspektrumpenicillinen und Antibiotikakombinationen führt besonders häufig zu einer AAD [2].
Pathophysiologie der AAD
Die Mikrobiota des menschlichen Darmtrakts setzt sich aus ca. 100 Billionen aeroben und anaeroben Darmbakterien zusammen, welche eine entscheidende Bedeutung für die menschliche Gesundheit und bei der Verdauung spielen. Bei der Verdauung sind die Bakterien insbesondere für die Verstoffwechselung bestimmter Kohlenhydrate von essentieller Natur, welche mit Hilfe körpereigener Enzyme nicht aufgespalten werden können. Diese sogenannten Ballaststoffe werden durch die Darmbakterien in die kurzkettigen Fettsäuren Essigsäure, Propionsäure und Buttersäure umgesetzt, welche unter anderem von den Kolonozyten als wichtige Energiequelle genutzt werden. Diese kurzkettigen Fettsäuren werden von den Kolonozyten zusammen mit Natriumionen aufgenommen. Der dabei entstehende osmotische Gradient führt dazu, dass zusätzlich auch Wasser von den Kolonozyten aufgenommen und folglich der Stuhl eingedickt wird [3].
Da Antibiotika nicht selektiv zwischen pathogenen und apathogenen Bakterien unterscheiden, wird durch die Antibiotikaeinnahme die Gesamtheit der intestinalen Mikrobiota signifikant dezimiert [4, 5]. Die dadurch reduzierte Fermentationsleistung hat zur Folge, dass vermehrt osmotisch wirkende Ballaststoffe im Kolon verbleiben, nicht in kurzkettige Fettsäuren verstoffwechselt und nicht zusammen mit Natrium und Wasser von den Kolonozyten aufgenommen werden. Der Darminhalt wird weniger eingedickt und eine Diarrhö kann resultieren [6].
Probiotika
Bei Probiotika handelt es sich um lebende Mikroorganismen, die dem Wirt einen gesundheitlichen Nutzen bringen, wenn sie in ausreichender Menge verabreicht werden [7]. Da es unter den Probiotika sowohl Bakterien als auch Hefen gibt, werden diese zwei Gruppen unterschieden. Die Gruppe der Bakterien ist dabei deutlich umfangreicher vertreten - jedoch bedeutet dies nicht, dass Hefen weniger relevant wären.
Probiotika werden seit vielen Jahren in diversen Anwendungsgebieten verwendet. Vor allem die Anwendung zur Prävention der AAD wurde für verschiedenste Probiotika in zahlreichen Studien untersucht. Ein aktuelles Cochrane Review aus dem Jahr 2019 verweist im Fazit darauf, dass Probiotika - im Allgemeinen - eine moderate Wirkung hinsichtlich der Prävention der AAD bei Kindern besitzen [8]. Die Wirkung einzelner Probiotika wird allerdings als stammspezifisch angesehen, sodass in der vorliegenden Arbeit die stammspezifische, evidenzbasierte Wirkung verschiedener Probiotika analysiert und verglichen werden soll. Aufgrund der großen Anzahl an Probiotika und der unterschiedlichen Kombinationsvarianten wurde die Auswahl der in diesem Review untersuchten Probiotika auf solche reduziert, welche laut der World Gastroenterology Organisation (WGO) eine evidenzbasierte Wirkung (Evidenzlevel: 1-3) zur Prävention der AAD aufweisen [7]. Dabei handelt es sich um die folgenden Probiotika und Kombinationen:
-
Joghurt mit Lactobacillus (L.) casei DN114, L. bulgaricus und Streptococcus (S.) thermophilus
-
L. acidophilus CL1285 und L. casei (Bio-K+CL1285)
-
L. rhamnosus GG
-
Saccharomyces (S.) boulardii CNCM I-745
-
L. reuteri DSM 17938
-
L. acidophilus NCFM, L. paracasei Lpc-37, Bifidobacterium (B.) lactis Bi-07, B. lactis Bl-04
-
B. bifidum W23, B. lactis W18, B. longum W51, Enterococcus (E.) faecium W54, L. acidophilus W37 und W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 und L. salivarius W24
Für die Vergabe des Evidenzlevel 1 wurde von der WGO ein systematischer Review von randomisierten Studien oder eine "n-of-1"-Studie gefordert. Voraussetzung für die Bewertung mit dem Evidenzlevel 2 war eine randomisierte Studie oder eine Beobachtungsstudie mit deutlicher Wirkung. Das Vorhandensein einer nicht-randomisierten, kontrollierten Kohorte/Nachbeobachtungsstudie führte zu dem Evidenzlevel 3.
Um die Probiotika im Hinblick auf ihre klinische Evidenz zur Prävention der AAD zu betrachten, wurde eine systematische Recherche der vorhandenen Literatur bis Oktober 2020 in den Datenbanken MEDLINE und EMBASE durchgeführt. Bei der Auswahl der Literatur war entscheidend, dass die durch Antibiotika hervorgerufene Diarrhö im Fokus der Untersuchung stand. Tab. 1 zeigt die Anzahl sowie das Studiendesign aller klinischen Untersuchungen, welche im Rahmen der Literaturrecherche identifiziert und in diesem Review betrachtet wurden. Zudem beinhaltet Tab. 1 einen Überblick über die untersuchten Patientengruppen, die Anzahl der eingeschlossenen Patienten, ob die Behandlung ambulant oder stationär erfolgte, sowie die Anzahl der Studien, welche einen signifikanten Unterschied zur Kontrollgruppe aufwiesen.
S. boulardii CNCM I-745
Mit 19 klinischen Studien, darunter 18 RCTs durchgeführt an Kindern und Erwachsenen, handelt es sich bei S. boulardii CNCM I-745 um das am umfangreichsten untersuchte Probiotikum zur Prävention einer AAD. Über 4400 Patienten wurden in den Studien eingeschlossen, welche sowohl mit ambulanten als auch mit stationären Patienten durchgeführt worden sind. In den Studien, an denen Kinder teilgenommen haben, lag die tägliche Dosierung bei 250-500 mg (≙ mindestens 4,5-9×109 Kolonie-bildende Einheiten [KBE]), bei Erwachsenen wurde eine höhere Dosierung von 500-1000 mg (≙ mindestens 9×109-1,8×1010 KBE) getestet.
Von insgesamt 19 publizierten Studien konnte in 14 Studien ein signifikanter Effekt hinsichtlich der Prävention der AAD mit S. boulardii CNCM I-745 im Vergleich zur Kontrollgruppe, gefunden werden. Frühere Metaanalysen zu S. boulardii CNCM I-745 zeigen eine signifikante, präventive Wirksamkeit auf [46, 47]: Eine Auswertung der Studien an Kindern zeigt, dass die präventive Einnahme von S. boulardii CNCM I-745 das Risiko einer AAD im Vergleich zu Placebo signifikant von 20,9% auf 8,8% (RR [relatives Risiko]: 0,43; 95% CI [Konfidenzintervall]: 0,3-0,6) senken konnte. Bei Erwachsenen zeigte sich gegenüber Placebo eine signifikante Reduktion des AAD-Risikos von 17,4% auf 8,2% (RR: 0,49; 95% CI: 0,38-0,63) [46]. Über die Gesamtpopulation konnte ein signifikanter Unterschied des AAD-Risikos von 18,7% (Placebo) auf 8,5% (S. boulardii CNCM I-745) (RR: 0,47; 95% CI: 0,38-0,57) errechnet werden.
Verschiedene klinische Leitlinien empfehlen basierend auf dieser klinischen Evidenz die Anwendung von S. boulardii CNCM I-745. In der Leitlinie der WGO wird S. boulardii CNCM I-745 mit dem höchsten Evidenzlevel von 1 für die Prävention der AAD bei Kindern und Erwachsenen bewertet [7]. Die Arbeitsgruppe zu Probiotika von der Europäischen Gesellschaft für pädiatrische Gastroenterologie, Hepatologie und Ernährung (ESPGHAN) empfiehlt in ihrer Leitlinie zur Prävention der AAD bei Kindern neben Lactobacillus rhamnosus GG (LGG) S. boulardii CNCM I-745, wenn die Einnahme von Probiotika in Betracht gezogen werden soll (Empfehlung: stark, Quality of Evidence: moderat) [48].
L. rhamnosus GG (LGG)
LGG zählt mit 8 klinischen Studien bei Kindern und Erwachsenen (darunter 6 RCTs) zu den umfangreich untersuchten Probiotika bei der Prävention der AAD. Studienübergreifend wurden über 900 ambulante und hospitalisierte Patienten in die Studien eingeschlossen. Die tägliche Dosierung bei Kindern betrug 5×109-8×1010 KBE. Die Dosierung bei Erwachsenen lag mit 1,2×1010-2×1010 KBE pro Tag im Dosierungsbereich der Kinder. Im Vergleich zu den Studien mit niedriger Dosierung, zeigten die Studien mit höherer Dosierung keinen signifikanten Unterschied zur Kontrollgruppe auf [30, 32, 35]. Als mögliche Ursache der nicht-signifikanten Ergebnisse vermuten die Autoren dieser Studien zu geringe Fallzahlen [30, 32] sowie, im Falle von Thomas et al., 2001, u.a. eine zu hohe Konzentration intravenös verabreichter Antibiotika, welche folglich die Konzentration der lebensfähigen LGG reduziert haben könnte [35]. Die klinischen Studien mit LGG wurden in einer Metaanalyse untersucht [49]. Für die Gesamtpopulation wurde im Vergleich zu Placebo eine signifikante Reduktion des AAD-Risikos von 22,4% auf 12,3% (RR: 0,49, 95% CI: 0,29-0,83) errechnet. Eine separate Analyse der Ergebnisse bei Kindern ergab einen signifikanten präventiven Effekt (RR: 0,48; 95% CI: 0,26-0,89). Eine signifikante Reduktion des AAD-Risikos bei Erwachsenen konnte jedoch nicht ermittelt werden (RR: 0,48; 95% CI: 0,20-1,15). Dies mag darin begründet sein, dass eine Studie an hospitalisierten Erwachsenen (und hoher LGG-Dosierung) keinen signifikanten Effekt aufwies. Folglich ist eine Anwendung von LGG in dieser Patientengruppe nicht empfohlen.
Die WGO bewertet die Wirksamkeit von LGG sowohl bei Kindern als auch bei Erwachsenen mit dem Evidenzlevel 1 [7]. Die Arbeitsgruppe zu Probiotika von der ESPGHAN empfiehlt in ihrer Leitlinie den Einsatz von LGG zur Prävention einer AAD bei Kindern, wenn die Einnahme von Probiotika in Betracht gezogen werden soll (Empfehlung: stark, Quality of Evidence: moderat) [48].
Kombination aus L. acidophilus CL1285 und L. casei (Bio-K+CL1285)
Die Wirksamkeit einer Kombination aus L. acidophilus CL1285 und L. casei (Bio-K-CL1285) wurde in 3 klinischen RCTs an fast 800 Erwachsenen untersucht. Die Dosierung lag zwischen 2,5-10×1010 KBE pro Tag. Zwei Untersuchungen wurden an stationären Patienten durchgeführt, welche eine signifikante Reduktion der Häufigkeit einer AAD gegenüber Placebo aufzeigten (15,9% vs. 35,6%, p = 0,05; 15,5% vs. 44,1%, p ≤ 0,001) [36, 37]. Eine Studie sowohl an ambulanten wie auch hospitalisierten Patienten zeigte keine signifikante Reduktion des AAD-Risikos im Vergleich zur Kontrollgruppe auf (21,8% vs. 29,4%, p = 0,067) [38]. Somit liegen aus klinischen Studien keine Belege für die Wirksamkeit der Kombination bei ambulanten Erwachsenen oder bei Kindern vor, sodass eine Anwendung in diesen Patientengruppen nicht empfohlen wird.
Die WGO bewertet die Wirksamkeit von L. acidophilus CL1285 und L. casei (Bio-K+CL1285) bei Erwachsenen mit dem Evidenzlevel 1. Aufgrund der nicht vorhandenen pädiatrischen Daten ist diese Kombination für Kinder weder in der WGO Leitlinie noch in der Leitlinie der ESPGHAN aufgeführt [7, 48].
Kombination aus L. casei DN114, L. bulgaricus und S. thermophilus
Die Wirksamkeit der Kombination aus L. casei DN114, L. bulgaricus und S. thermophilus hinsichtlich der Prävention der AAD wurde in einer klinischen RCT an 113 hospitalisierten Erwachsenen untersucht. Ein signifikanter Unterschied, in Bezug auf das AAD-Risiko, konnte zwischen der Verum- und der Placebogruppe aufgezeigt werden (12% vs. 34%, p = 0,007) [39]. Die Dosierung lag bei 200 mL (entspricht 4,2×1010 KBE) pro Tag. Zur Anwendung dieser Kombination an ambulanten Erwachsenen und ambulanten und stationären Kindern liegen keine Erkenntnisse vor, sodass die Einnahme bei diesen Patientengruppen nicht empfehlenswert ist.
Die WGO bewertet die Wirksamkeit dieser Kombination bei Erwachsenen mit dem Evidenzlevel 1. Eine Empfehlung bei Kindern wird weder durch die WGO noch durch die ESPGHAN ausgesprochen [7, 48].
Kombination aus L. acidophilus NCFM, L. paracasei Lpc-37, B. lactis Bi-07 und B. lactis Bl-04
In einer klinischen RCT mit 335 hospitalisierten Erwachsenen wurde die Wirksamkeit der Kombination aus L. acidophilus NCFM, L. paracasei Lpc-37, B. lactis Bi-07 und B. lactis Bl-04 untersucht. Es wurden zwei unterschiedliche Dosierungen (4,17×109 KBE und 1,7×1010 KBE pro Tag) getestet. Die höhere Dosierung, nicht hingegen die niedrigere Dosierung, zeigte einen signifikanten Unterschied in der Häufigkeit der AAD gegenüber Placebo auf (niedrigere Dosierung: 19,6% vs. 24,6%, p = 0,28; höhere Dosierung: 12,5% vs. 24,6%, p = 0,005) [40]. Da weder Daten zu Kindern noch zur Anwendung bei ambulanten Erwachsenen vorliegen, ist die Einnahme bei diesen Patientengruppen nicht empfehlenswert.
Die WGO bewertet die Wirksamkeit dieser Kombination bei Erwachsenen mit dem Evidenzlevel 2. Die Anwendung dieser Kombination wird aufgrund nicht vorhandener Daten bei Kindern weder durch die WGO noch durch die ESPGHAN empfohlen [7, 48].
Kombination aus B. bifidum W23, B. lactis W18, B. longum W51, E. faecium W54, L. acidophilus W37 und W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 und L. salivarius W24
Die Wirksamkeit der Kombination wurde mit Hilfe einer RCT und einer offenen, unkontrollierten Studie untersucht. Die RCT wurde an 40 gesunden, erwachsenen Probanden ambulant durchgeführt. Die Dosierung lag bei 1010 KBE pro Tag. In der Publikation wird darauf hingewiesen, dass Diarrhö-ähnliche Darmbewegungen unter Einnahme der Probiotikakombination im Vergleich zum Placebo signifikant seltener auftraten (48% vs. 79%, p < 0,05). Diese wurden wie folgt definiert: Mindestens drei Stuhlgänge pro Tag und/oder eine Stuhlkonsistenz mit einem Score von 5 (auf einer Skala von 1 [hart] bis 7 [wässrig]) oder höher an mindestens zwei Tagen [42]. Die Weltgesundheitsorganisation (WHO) definiert eine Diarrhö wie folgt: drei oder mehr ungeformte oder flüssige Stühle pro Tag [50]. Somit wird deutlich, dass allein eine erhöhte Darmtätigkeit (mind. 3 Stuhlgänge pro Tag) oder allein eine verminderte Stuhlkonsistenz nicht als Diarrhö definiert ist, sondern die Kombination aus der erhöhten Anzahl und der verminderten Stuhlkonsistenz erforderlich ist. Werden die Studienergebnisse gemäß der Definition der WHO betrachtet, wird ersichtlich, dass die Studie hinsichtlich des Risikos einer AAD keinen signifikanten Unterschied zwischen der Probiotika- und der Placebogruppe aufzeigen konnte (16% vs. 26%; p > 0,05) [42].
In der offenen Studie wurden 199 hospitalisierte Erwachsene beobachtet, welche zusätzlich zu einer Antibiotikatherapie die entsprechende Probiotikakombination einnahmen. In dieser Patientenpopulation zeigte sich eine sehr geringe Häufigkeit der AAD (0,5%) [41]. Da die Studie jedoch ohne Kontrollgruppe durchgeführt wurde, ist die Aussagekraft sehr begrenzt und die Beurteilung eines signifikanten Effektes nicht möglich. Die Anwendung dieser Probiotikakombination zur Prävention der AAD ist folglich nur eingeschränkt und nur bei hospitalisierten Erwachsenen empfehlenswert.
Die WGO bewertet die Kombination bei Erwachsenen mit dem Evidenzlevel 2. Es liegt keine Empfehlung für die Anwendung bei Kindern durch die WGO oder die ESPGHAN vor [7, 48].
L. reuteri DSM 17938
Die Wirksamkeit von L. reuteri DSM 17938 wurde in drei RCTs an 367 hospitalisierten Kindern und Erwachsenen untersucht. Die Dosierung lag bei 2×108 KBE bei Erwachsenen und 1-2×108 KBE bei Kindern. Die Studie an hospitalisierten Erwachsenen zeigte für die Verumgruppe eine signifikante Reduktion der Häufigkeit einer AAD im Vergleich zu Placebo auf (7,7% vs. 50%, p = 0,02) [45]. Die Studien an Kindern zeigten für dieses Probiotikum keinen signifikanten Effekt hinsichtlich des AAD-Risikos im Vergleich zur Placebogruppe (2,0% vs. 2,1%, p > 0,05; 11,4% vs. 6,5%, p > 0,05) [43, 44]. Für die Anwendung bei ambulant behandelten Erwachsenen liegen keine klinischen Daten vor, sodass die Anwendung für diese Patientengruppe sowie für Kinder nicht empfehlenswert ist. Auch die RCT an hospitalisierten Erwachsenen besitzt aufgrund der geringen Patientenzahl (23 eingeschlossene Patienten) trotz signifikanten Ausgangs nur eine eingeschränkte Aussagekraft.
L. reuteri DSM 17938 wird von der WGO bei Erwachsenen mit dem Evidenzlevel 3 bewertet. Eine Empfehlung zur Anwendung bei Kindern liegt weder in der Leitlinie der WGO noch der ESPGHAN vor [7, 48].
Zusammenfassung der klinischen Wirksamkeit der Probiotika und der Empfehlung in internationalen Leitlinien
Basierend auf der ausführlichen Literaturrecherche und der Beurteilung der Studien wurde die evidenzbasierte Wirksamkeit der verschiedenen Probiotika hinsichtlich der Prävention der AAD in Bezug auf unterschiedliche Patientengruppen in Tab. 2 dargestellt.
Die stammspezifischen Empfehlungen der ESPGHAN-Leitlinie sowie die vergebenen Evidenzlevel aus der WGO-Leitlinie sind für alle untersuchten Probiotika und Probiotikakombinationen in Tab. 3 gelistet. Die Evidenzlevel der unterschiedlichen Probiotika oder Probiotikakombinationen bei der Prävention der AAD wurden von der WGO sowohl im Hinblick auf die Anwendung bei Kindern wie auch bei Erwachsenen bewertet. Die Bewertung der ESPGHAN bezieht sich ausschließlich auf das Patientenkollektiv Kinder.
Fazit
Aufgrund der Vielzahl an Probiotika und Probiotikakombinationen sowie deren stammspezifischen Wirkmechanismen ist es nicht möglich, eine allgemeine Aussage über die Wirksamkeit aller Probiotika zu treffen. Es ist hingegen erforderlich, jedes Probiotikum auf seine individuelle Wirksamkeit und Evidenz im Hinblick auf verschiedene Anwendungsgebiete und Patientengruppen zu untersuchen.
Die vorliegende Literaturrecherche zeigt auf, dass S. boulardii CNCM I-745 mit 19 vorhandenen klinischen Studien das am umfangreichsten untersuchte Probiotikum hinsichtlich der Prävention der AAD ist. Zudem weist S. boulardii CNCM I-745 als einziges Probiotikum in jeder Patientengruppe (hospitalisiert und ambulant behandelte Kinder und Erwachsene) eine evidenzbasierte Wirksamkeit zur Prävention der AAD auf. Auch für L. rhamnosus GG liegt hinsichtlich der Prävention der AAD bei Kindern und ambulanten Erwachsenen eine gute Studienlage vor. Die sehr gute, evidenzbasierte Wirksamkeit beider Probiotika hinsichtlich der Prävention der AAD bei Kindern spiegelt sich in der entsprechenden Empfehlung seitens der ESPGHAN wider.
Auf Basis der klinischen Daten erwiesen sich die Kombinationen aus L. acidophilus CL1285 und L. casei (Bio-K+CL1285), aus L. casei DN114, L. bulgaricus und S. thermophilus sowie aus L. acidophilus NCFM, L. paracasei Lpc-37, B. lactis Bi-07 und B. lactis Bl-04 bei hospitalisierten Erwachsenen als wirksam.
Aufgrund des zugrundeliegenden Studiendesigns bzw. der geringen Anzahl an Patienten weisen die Kombination aus B. bifidum W23, B. lactis W18, B. longum W51, E. faecium W54, L. acidophilus W37 und W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 und L. salivarius W24 sowie das Probiotikum L. reuteri DSM 17938 nur eine sehr eingeschränkte Evidenz auf. Zudem liegen positive Daten hinsichtlich der Prävention der AAD lediglich für hospitalisierte Erwachsene vor. Die Evidenz dieser Probiotika hinsichtlich der Prävention der AAD sollte in RCTs mit ausreichender Patientenzahl, entsprechender Patientenpopulation und angemessenem Studiendesign untersucht werden.
Empfehlung für den klinischen Alltag
Grundsätzlich kann jedes Antibiotikum bei jedem Patienten eine AAD auslösen. Die Entscheidung zur Antibiotika-begleitenden, präventiven Einnahme eines Probiotikums sollte für jeden Patienten individuell und unter Beachtung der Gegenanzeigen getroffen werden. Besonders bei langfristigen Antibiotikatherapien, Patienten mit bekannter AAD-Historie oder der Verwendung von Antibiotika mit besonders hohem AAD-Risiko (bspw. Breitspektrumpenicillinen oder Antibiotikakombinationen wie Amoxicillin/Clavulansäure) sollte die präventive Einnahme eines Probiotikums in Betracht gezogen werden. Das Patientenalter sowie Komorbiditäten sind ebenfalls zu berücksichtigen.
Auch bei Patienten mit geringem AAD-Risiko kann eine probiotische AAD-Prävention sinnvoll sein, da eine unangenehme AAD-Symptomatik die Compliance der Antibiotikaeinnahme reduzieren und somit indirekt auch den Therapieerfolg des Antibiotikums negativ beeinflussen kann. Nicht zuletzt sollte auch der Patientenwunsch mit in die Entscheidung einbezogen werden.
Wenn Probiotika zur Prävention der AAD angewendet werden sollen, empfiehlt es sich grundsätzlich ein Probiotikum mit evidenzbasierter Wirkung auszuwählen wie beispielsweise S. boulardii CNCM I-745 oder Lactobacillus rhamnosus GG.
Literatur
McFarland LV. Antibiotic-associated diarrhea: epidemiology, trends and treatment. Future Microbiol 2008; 3(5): 563-578.
Stein J. Antibiotikaassoziierte Diarrhö und pseudomembranöse Kolitis. In: Caspary WF, Mössner J, Stein J (Hrsg). Therapie gastroenterologischer Krankheiten. Springer, Berlin 2005, S. 169-175.
More MI, Swidsinski A. Saccharomyces boulardii CNCM I-745 supports regeneration of the intestinal microbiota after diarrheic dysbiosis - a review. Clin Exp Gastroenterol 2015; 11: 237-255.
Maier L, Pruteanu M, Kuhn M, et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature 2018; 555(7698): 623-628.
Swidsinski A, Loening-Baucke V, Schulz S, Manowsky J, Verstraelen H, Swidsinski S. Functional anatomy of the colonic bioreactor: Impact of antibiotics and Saccharomyces boulardii on bacterial composition in human fecal cylinders. Syst Appl Microbiol 2016; 39(1): 67-75.
Clausen MR, Bonnen H, Tvede M, Mortensen PB. Colonic fermentation to short-chain fatty acids is decreased in antibiotic-associated diarrhea. Gastroenterology 1991; 101(6): 1497-504.
Guarner F, Sanders ME, Eliakim R, et al. World Gastroenterology Organisation Global Guidelines: Probiotics and prebiotics. 2017.
Guo Q, Goldenberg JZ, Humphrey C, El Dib R, Johnston BC. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev 2019; 4: CD004827.
Bin Z, Ya-Zheng X, Zhao-Hui D, Bo C, Li-Rong J, Vandenplas Y. The efficacy of Saccharomyces boulardii CNCM I-745 in addition to standard helicobacter pylori eradication treatment in children. Pediatr Gastroenterol Hepatol Nutr 2015; 18(1): 17-22.
Casem RAO. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhea in children: a randomized controlled trial. PIDSP 2013; 13(2): 70-76.
Erdeve O, Tiras U, Dallar Y. The probiotic effect of Saccharomyces boulardii in a pediatric age group. J Trop Pediatr 2004; 50(4): 234-236.
Kotowska M, Albrecht P, Szajewska H. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea in children: a randomized double-blind placebo-controlled trial. Aliment Pharmacol Ther 2005; 21(5): 583-590.
Shan LS, Hou P, Wang ZJ, et al. Prevention and treatment of diarrhoea with Saccharomyces boulardii in children with acute lower respiratory tract infections. Benef Microbes 2013; 4(4): 329-334.
Wan CM, Yu H, Liu G, et al. A multicenter randomized controlled study of Saccharomyces boulardii in the prevention of antibiotic-associated diarrhea in infants and young children. Zhonghua Er Ke Za Zhi 2017; 55(5): 349-354.
Adam M, et al. Controlled double blind clinical trials of Saccharomyces boulardii: Multicentre study involving 25 physicians and 388 cases. Med Chirurg Dig 1976; 5(6): 401-406.
Bravo MV, Bunout D, Leiva L, et al. Effect of probiotic Saccharomyces boulardii on prevention of antibiotic-associated diarrhea in adult outpatients with amoxicillin treatment. Rev Med Chil 2008; 136(8): 981-988.
Can M, Besirbellioglu BA, Avci IY, Beker CM, Pahsa A. Prophylactic Saccharomyces boulardii in the prevention of antibiotic-associated diarrhea: a prospective study. Med Sci Monit 2006; 12(4): I19-I22.
Cindoruk M, Erkan G, Karakan T, Dursun A, Unal S. Efficacy and safety of Saccharomyces boulardii in the 14-day triple anti-Helicobacter pylori therapy: a prospective randomized placebo-controlled double-blind study. Helicobacter 2007; 12(4): 309-316.
Cremonini F, Di Caro S, Covino M, et al. Effect of different probiotic preparations on anti-helicobacter pylori therapy-related side effects: a parallel group, triple blind, placebo-controlled study. Am J Gastroenterol 2002; 97(11): 2744-2749.
Duman DG, Bor S, Ozutemiz O, et al. Efficacy and safety of Saccharomyces boulardii in prevention of antibiotic-associated diarrhoea due to Helicobacterpylori eradication. Eur J Gastroenterol Hepatol 2005; 17(12): 1357-1361.
Ehrhardt S, Guo N, Hinz R, et al. Saccharomyces boulardii to prevent antibiotic-associated diarrhea: a randomized, double-masked, placebo-controlled trial. Open Forum Infect Dis 2016; 3(1): ofw011.
Lewis SJ, Freedman AR. Review article: the use of biotherapeutic agents in the prevention and treatment of gastrointestinal disease. Aliment Pharmacol Ther 1998; 12(9): 807-822.
McFarland LV, Surawicz CM, Greenberg RN, et al. Prevention of beta-lactam-associated diarrhea by Saccharomyces boulardii compared with placebo. Am J Gastroenterol 1995; 90(3): 439-448.
Pozzoni P, Riva A, Bellatorre AG, et al. Saccharomyces boulardii for the prevention of antibiotic- associated diarrhea in adult hospitalized patients: a single-center, randomized, double-blind, placebo-controlled trial. Am J Gastroenterol 2012; 107(6): 922-931.
Surawicz CM, Elmer GW, Speelman P, McFarland LV, Chinn J, van Belle G. Prevention of antibiotic-associated diarrhea by Saccharomyces boulardii: a prospective study. Gastroenterology 1989; 96(4): 981-988.
Zhang DM, Xu BB, Yu L, Zheng LF, Chen LP, Wang W. A prospective control study of Saccharomyces boulardii in prevention of antibiotic-associated diarrhea in the older inpatients. Zhonghua Nei Ke Za Zhi 2017; 56(6): 398-401.
Monteiro E, Fernandes JP, Vieira MR, et al. Double blind clinical trial on the use of ultra-levure in the prophylaxis of antibiotic induced gastro-intestinal and mucocutaneous disorders. Acta Med Port 1981; 3(2): 143-145.
Arvola T, Laiho K, Torkkeli S, et al. Prophylactic Lactobacillus GG reduces antibiotic-associated diarrhea in children with respiratory infections: a randomized study. Pediatrics 1999; 104(5): e64.
Esposito C, Roberti A, Turrà F, et al. Frequency of antibiotic-associated diarrhea and related complications in pediatric patients who underwent hypospadias repair: a comparative study using probiotics vs placebo. Probiotics Antimicrob Proteins 2018; 10(2): 323-328.
King SN, Chung AM, Vidal R, Walton S, Bonafante E, Falkos S. A randomized, double-blind, placebo controlled trial to assess the efficacy of Lactobacillus GG in the prevention of antibioticassociated diarrhea in the Pediatric Intensive Care Unit (PICU). Pharmacotherapy 2010; 30(10): 457e-8e.
Vanderhoof JA, Whitney DB, Antonson DL, Hanner TL, Lupo JV, Young RJ. Lactobacillus GG in the prevention of antibiotic-associated diarrhea in children. J Pediatr 1999; 135(5): 564-568.
Vaisanen L, Leskinen M, Siitonen A. Occurence of diarrhea in children receiving oral antibiotics with or without probiotic supplementation with Lactobacillus GG. Microb Ecol Health Dis 1998; 10: 199-200.
Armuzzi A, Cremonini F, Bartolozzi F, et al. The effect of oral administration of Lactobacillus GG on antibiotic-associated gastrointestinal side-effects during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther 2001; 15(2): 163-169.
Armuzzi A, Cremonini F, Ojetti V, et al. Effect of Lactobacillus GG supplementation on antibiotic-associated gastrointestinal side effects during Helicobacter pylori eradication therapy: a pilot study. Digestion 2001; 63(1): 1-7.
Thomas MR, Litin SC, Osmon DR, Corr AP, Weaver AL, Lohse CM. Lack of effect of Lactobacillus GG on antibiotic-associated diarrhea: a randomized, placebo-controlled trial. Mayo Clin Proc 2001; 76(9): 883-889.
Beausoleil M, Fortier N, Guénette S, et al. Effect of a fermented milk combining Lactobacillus acidophilus Cl1285 and Lactobacillus casei in the prevention of antibiotic-associated diarrhea: a randomized, double-blind, placebo-controlled trial. Can J Gastroenterol 2007; 21(11): 732-736.
Gao XW, Mubasher M, Fang CY, Reifer C, Miller LE. Dose-response efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients. Am J Gastroenterol 2010; 105(7): 1636-1641.
Sampalis J, Psaradellis E, Rampakakis E. Efficacy of BIO K+ CL1285 in the reduction of antibiotic-associated diarrhea - a placebo controlled double-blind randomized, multi-center study. Arch Med Sci 2010; 6(1): 56-64.
Hickson M, D'Souza AL, Muthu N, et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial. BMJ 2007; 335(7610): 80.
Ouwehand AC, DongLian C, Weijian X, et al. Probiotics reduce symptoms of antibiotic use in a hospital setting: a randomized dose response study. Vaccine 2014; 32(4): 458-463.
Lang FC. Use of a multi-species probiotic. Nutrafoods 2010; 9(2): 27-31.
Koning CJ, Jonkers DM, Stobberingh EE, Mulder L, Rombouts FM, Stockbrugger RW. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin. Am J Gastroenterol 2008; 103(1): 178-189.
Georgieva M, Pancheva R, Rasheva N, Usheva N, Ivanova L, Koleva K. Use of the probiotic Lactobacillus reuteri DSM 17938 in the prevention of antibiotic-associated infections in hospitalized bulgarian children: a randomized, controlled trial. J IMAB 2015; 21(4): 895-900.
Kołodziej M, Szajewska H. Lactobacillus reuteri DSM 17938 in the prevention of antibiotic-associated diarrhoea in children: a randomized clinical trial. Clin Microbiol Infect 2019; 25(6): 699-704.
Cimperman L, Bayless G, Best K, et al. A randomized, double-blind, placebo-controlled pilot study of Lactobacillus reuteri ATCC 55730 for the prevention of antibiotic-associated diarrhea in hospitalized adults. J Clin Gastroenterol 2011; 45(9): 785-789.
Szajewska H, Kolodziej M. Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther 2015; 42(7): 793-801.
Szajewska H, Mrukowicz J. Meta-analysis: non-pathogenic yeast Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther 2005; 22(5): 365-372.
Szajewska H, Canani RB, Guarino A, et al. Probiotics for the prevention of antibiotic-associated diarrhea in children. J Pediatr Gastroenterol Nutr 2016; 62(3): 495-506.
Szajewska H, Kolodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther 2015; 42(10): 1149-1157.
WHO. Diarrhoeal disease 2017 [updated 2 May 2017]. Available from: https://www.who.int/en/news-room/fact-sheets/detail/diarrhoeal-disease.
Author information
Authors and Affiliations
Corresponding author
Ethics declarations
Prof. Dr. med. Martin Storr erhielt Honorare für Vorträge/Beratung von Dr. Falk Pharma, Synformulas, Dr. Kade, Microbiotica, GE Healthcare, Medice, Salus, Klinge und HlH Biopharma. Prof. Dr. med. Andreas Stengel erhielt Honorare für Vorträge/Beratung von a + r Berlin, Boehringer-Ingelheim, Dr. Wilmar Schwabe, Medice, Microbiotica und Takeda.
Die Arbeit wurde unterstützt von der MEDICE Arzneimittel Pütter GmbH & Co. KG, Iserlohn.
Rights and permissions
About this article
Cite this article
Storr, M., Stengel, A. Klinische Evidenz zu Probiotika in der Prävention einer Antibiotika-assoziierten Diarrhö. MMW - Fortschritte der Medizin 163 (Suppl 4), 19–26 (2021). https://doi.org/10.1007/s15006-021-9762-5
Published:
Issue Date:
DOI: https://doi.org/10.1007/s15006-021-9762-5